Mục tiêu:
1. Trình bày được sự vận chuyển, trao đổi O2 và CO2 trong máu
2. Trình bày được thành phần và khả năng đệm của các hệ đệm của máu
3. Trình bày được vai trò của phổi và thận trong điều hòa thăng bằng acid-base trong cơ
thể
4. Trình bày được các loại rối loạn thăng bằng acid-base
PHẦN 1:
SỰ VẬN CHUYỂN KHÍ
1.1. sự vận chuyển o2
trong máu
1.1.1. Vai trò vận
chuyển O2 của hemoglobin
* Phần lớn O2 được vận chuyển trong máu nhờ gắn với hemoglobin
+ Ở 38 oC, 1L huyết tương chỉ hòa tan được 2,3 mL O2
+ 1g hemoglobin có khả năng vận chuyển 1,34 mL O2
+ 1L máu (chứa khoảng 150g hemoglobin) có khả năng vận chuyển 200 mL O2 (gấp 87 lần khả năng của
huyết tương)
+ Hemoglobin là chất mang O2 lý tưởng, bão hòa được 90% O2 ở phổi, 35% ở cơ đang hoạt động.
+ Sự gắn O2 của hemoglobin là sự cộng tác. Ở áp lực O2 thấp, sự gắn O2 tương đối yếu. Ở áp lực
O2 cao, hemoglobin gắn chặt với O2
1.1.2. Các yếu tố ảnh
hưởng đến sự gắn O2 của hemoglobin
+ 2,3 diphosphoglycerat (2,3-DPG): có tác dụng làm giảm ái lực của hemoglobin với O2 tạo điều kiện
cho sự giải phóng O2 ở các mô, nơi
có áp lực O2 thấp, do đó làm tăng hiệu quả
vận chuyển O2
+ pCO2 tăng, pH giảm, nhiệt độ tăng làm giảm ái lực của hemoglobin với O2 tạo điều kiện thuận lợi
cho sự giải phóng O2 cung cấp cho
các mô.
đồ thị phân ly oxy:
CO2-HHb-DPG + O2 ↔ HbO2 + CO2 + DPG
+ H+
1.2. sự vận chuyển CO2 trong máu
* CO2 được vận chuyển
trong máu dưới 3 dạng:
1. Dạng
bicarbonat (HCO3-): là dạng vận chuyển chủ yếu của CO2 trong máu (chiếm khoảng 78%).
CO2 + H2O <== Carbonic
anhydrase ==> H2CO3 <==>
H+ + HCO3-
2. Dạng
carbamin: nhờ gắn với các nhóm amin tự do của hemoglobin (chiếm khoảng 13%)
R-NH2 + CO2 ↔ R-NH-COO-
+ H+
+ Vì pH trong hồng cầu là 7,2 nên các nhóm amin đều tích điện dương, muốn gắn CO2 phải có phản ứng:
R-NH3+ ↔ R-NH2 + H+
3. Dạng
hòa tan: chiếm khoảng 9%
1.3. khả năng đệm H+ sinh ra trong quá trình vận chuyển CO2
*Đệm H+ sinh ra trong vận chuyển CO2
- Bởi Hb: 50%
- Đệm khác: 10%
- Cơ chế đẳng hydro: 40%
sơ đồ vận chuyển O2 và sự vận chuyển CO2 đẳng hydro của hemoglobin:
PHẦN 2: THĂNG
BẰNG ACID- BASE
2.1. khái niệm pH, acid, base
* pH (tiếng Latin: pondus hydrogenii; tiếng Anh: power of hydrogen; tiếng Pháp: pouvoir
hydrogène) là chỉ số đo độ hoạt động
của các ion hydro (H+) trong dung dịch, được Sorensen đưa ra lần đầu tiên năm 1909.
* pH chính là chỉ số đo độ acid hay base của dung dịch
* pH của 1 dung dịch được xác định bởi nồng độ ion hydro (H+)
* pH = - log[H+]
* Acid – là chất giải phóng H+ trong dung dịch
+ Acid mạnh phân ly hoàn toàn (ví dụ: HCl)
+ Acid yếu phân ly ít (Ví dụ: H2CO3)
* Base – là chất nhận H+
+ Base mạnh
+ Base yếu
* H2O là chất phân ly yếu: H2O <=> H+ + OH-
* Trong điều kiện tiêu chuẩn, nước tinh khiết có pH=7, được coi là trung tính
* Dung dịch có pH<7 là dung dịch acid
* Dung dịch có pH>7 là dung dịch base
2.2. phương trình Henderson Haselbalch
* Tính pH của một hỗn hợp acid yếu và muối của nó:
+ Trong dung dịch, acid yếu sẽ phân ly: HA <=> H+ + A-
+ Hệ số phân ly: K = [H+] x [A-] / [HA]
→ [H+] = K x [HA] / [A-]
→ pH = pK + log[A-]/[HA]
2.3. sự thăng bằng
acid- base trong cơ thể sống
Cơ thể duy trì thăng bằng aid – base nhờ sự kết hợp giữa hoạt động sinh lý của phổi, thận và sự hoạt
động của các hệ đệm.
* Các hoạt động sinh
lý của phổi thận: kiểm soát lượng acid, base, hoặc CO2 thải ra
+ Thận đệm một lượng lớn acid hoặc base, mất vài giờ đến vài ngày để hoàn thành công việc này
+ Phổi thực hiện chức năng đệm trong vài phút đến vài giờ, không có khả năng thay đổi pH nhiều như
thận
* Các hệ đệm hóa học
một chất nhận H+ và loại bỏ chúng ra khỏi
dung dịch khi nồng độ H+ tăng, hoặc
giải phóng H+ vào dung dịch khi nồng
độ H+ giảm xuống
+ Đưa pH về bình thường trong vài giây
+ Ba hệ đệm chính : bicarbonat, phosphat và protein
2.3.1. khái niệm hệ đệm
* Hệ đệm: chống lại sự thay đổi pH khi thêm một acid hay base.
* Thành phần: thường chứa hỗn hợp một acid yếu với base liên hợp với nó.
* Cơ chế tác dụng của hệ đệm:
+ Khi thêm một acid mạnh vào dung dịch, phần base của hệ đệm sẽ tác dụng với acid mạnh để tạo
thành một acid yếu ít phân ly hơn,
lượng H+ tạo ra rất ít, không ảnh hưởng nhiều đến pH của dung dịch
+ Khi thêm một base mạnh, base này sẽ kết hợp với phần acid yếu của hệ đệm, bị trung hòa và tạo nên
một anion của acid yếu, do đó pH của
dung dịch cũng ít bị thay đổi
+ Khả năng đệm của dung dịch tốt nhất khi
[A-] = [HA], hay pH= pK
2.3.2. hệ đệm trong
cơ thể sống
* Của huyết tương và
dịch gian bào:
+ Bicarbonat: HCO3-/H2CO3
+ Phosphat: HPO42- / H2PO4-
+ Protein: proteinat/protein
* Của hồng cầu:
+ KHb/HHb
+ KHbO2/HHbO2
* Dịch trong tế bào:
chủ yếu là đệm phosphat và protein
(1) hệ đệm
bicacbonat (HCO3-/H2CO3 )
* Dung dịch acid carbonic và ion bicarbonat
+ CO2 + H2O <=> H2CO3 <=> HCO3- + H+
* Phương trình cho hệ đệm bicarbonat:
pH= pK + log[HCO3-]/[H2CO3]
(or)
pH= 6,1 + log[HCO3-]/[0,03.pCO2]
* Là hệ thống đệm chủ yếu của huyết tương và dịch gian bào.
* Hoạt động có liên quan mật thiết với phổi và thận
+ Để giảm pH, thận bài tiết HCO3-
+ Để tăng pH, thận bài tiết H+ và phổi bài tiết CO2
(2) hệ đệm
phosphat (HPO42- /H2PO4-)
H2PO4- <=> HPO42- + H+
Phản ứng theo chiều sang phải giải phóng H+ và giảm pH, phản ứng theo chiều sang trái tăng pH
* Đóng vai trò quan trọng dịch trong tế bào và ống thận vì:
+ Ở trong tế bào và ống thận nồng độ phosphat cao và hoạt động gần pH tối ưu là 6.8
+ Phản ứng chuyển hóa liên tục tạo acid làm pH trong tế bào từ 4.5 đến 7.4, trung bình là 7.0
(3) hệ đệm protein(Proteinat/Protein)
* Protein là một chất lưỡng tính. Hệ đệm protein hoạt động nhờ các gốc amin và gốc carboxyl
(NH3+ - R-COO-).
* Ở điểm đẳng điện, số điện tích dương và âm bằng nhau. Thêm ion H+, protein sẽ tích điện
dương và chuyển sang phía acid của
điểm đẳng điện. Khi mất H+,
protein tích điện âm và chuyển sang phía base của điểm đẳng điện.
* Như vậy trong môi trường acid, protein thể hiện tính kiềm và ngược lại.
(4) hệ đệm của hồng
cầu
* Gồm hệ đệm hemoglobinat/hemoglobin (KHb/HHb) và Oxy-hemoglobinat/Oxy-hemoglobin
(KHbO2/HHbO2)
* Đây là hệ đệm có hàm lượng rất lớn nên chúng có vai trò quan trọng trong điều hòa pH máu
qua sự vận chuyển O2 và CO2.
* Hệ đệm này đảm nhiệm 82% khả năng đệm của các hệ đệm trong máu.
2.3.3. khả năng đệm của
các hệ đệm trong cơ thể
*Khả năng đệm của các hệ đệm trong máu:
+ Hệ Hb: 82%
+ Hệ protein: 10%
+ Hệ bicarbonat: 7%
+ Hệ phosphat: 1%
*Khả năng đệm của các
hệ đệm trong cơ thể:
+ Tế bào: 52%
+ Dịch ngoài tế bào: 42%
+ Hồng cầu: 6%
2.3.4. vai trò của phổi
trong điều hòa thăng bằng acid- base
*Trung hòa acid mạnh hơn hệ đệm hóa học 2 đến 3 lần, phổi thực hiện chức năng đệm trong
vài phút nhưng không có khả năng đệm
lớn như thận
*tăng CO2 và giảm pH kích thích làm tăng thông khí phổi, trong khi tăng pH ức chế thông khí phổi
2.3.5. vai trò của thận trong điều hòa thăng bằng
acid- base
*Thận không tham gia chống lại tình trạng rối loạn thăng bằng acid- base ngay từ đầu mà sau nhiều giờ thận mới điều chỉnh. pH chỉ thực sự trở về sinh lý bình thường
sau khi đã có sự điều chỉnh của thận
*Có 3 cơ chế chính giúp thận điều hòa thăng bằng acid- base:
+Tái hấp thu bicarbonat ở ống lượn gần
+Đào thải các acid và muối acid không bay hơi ở ống lượn xa
+Bài tiết ion H+ dưới dạng muối amon ở ống lượn xa
bài tiết H+ và tái hấp thu bicacbonat:
bài tiết H+ dưới dạng muối phosphat:
2.4. các thông số
đánh giá thăng bằng acid-base
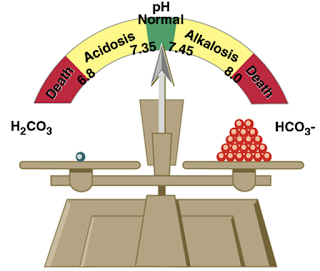
1. pH máu:
+ Giá trị bình thường: 7,38- 7,42
+ pH= 7,35- 7,38: xu hướng nhiễm acid (toan)
+ pH= 7,42- 7,45: xu hướng nhiễm base (kiềm)
+ pH< 7,35: nhiễm acid (toan)
+ pH>7,45: nhiễm base (kiềm)
2. pCO2:
+ Phân áp CO2 máu động mạch
+ Giá trị bình thường: 35- 45 mmHg
+ Điều hòa bởi hoạt động của phổi: pCO2 máu tỷ lệ nghịch với mức độ thông khí phế
nang
3. Bicarbonat thực
(AB= actual bicarbonat):
+ Là nồng độ bicarbonat trong máu thử, được lấy trong điều kiện không tiếp xúc với
không khí, tương ứng với pH và
pCO2 thực của máu
+ Giá trị bình thường: 25 mEq/L (mmol/L)
+ Phụ thuộc vào pCO2, khi pCO2 tăng AB cũng tăng theo
4. Bicarbonat chuẩn
(SB= standard bicarbonat):
+ Là nồng độ bicarbonat trong máu thử được đưa về điều kiện chuẩn: to= 37oC, PCO2
= 40 mmHg
+ Giá trị bình thường: 25 mEq/L (mmlo/L)
+ Chỉ thay đổi trong một số rối loạn acid- base chuyển hóa
5. Base đệm (BB=
buffer base):
+ Là tổng số nồng độ của các anion đệm trong máu (HCO3-, HPO42-, proteinat,
hemoglobinat…)
+ Giá trị bình thường: 46 mEq/L
+ Không phụ thuộc nhiều vào pCO2 máu nhưng phụ thuộc vào nồng độ hemoglobin trong
máu
6. Base dư (EB=
excess base):
+ Được xác định là lượng acid được thêm vào máu để đưa pH máu về 7,4 ở điều kiện chuẩn: to=37oC, pCO2 = 40 mmHg
+ Giá trị bình thường: 0
+ Nhiễm acid: EB có giá trị âm, nhiễm base: EB có giá trị dương.
2.5. rối loạn thăng bằng
acid - base
2.5.1. nhiễm acid
chuyển hóa
* Là hậu quả của sự tích tụ các acid cố định hoặc của sự mất chất base do tăng tạo acid hữu cơ
hoặc acid ngoại sinh đưa vào cơ thể,
bài tiết H+ giảm hoặc mất HCO3-
* Các biểu hiện đặc trưng:
+ pCO2 giảm
+ AB, SB, BB, EB giảm
+ pH giảm: còn bù (pH=7,35-7,4), mất bù (pH<7,35)
* Các bệnh lý có nhiễm
acid (toan) chuyển hóa:
+ Nhiễm toan cetone: do tăng chuyển hóa acid béo làm tăng sản xuất thể cetone (acetone, acid
acetylacetic, acid beta
hydroxybutyric). Hay gặp trong biến chứng
đái tháo đường, nhịn đói kéo dài, ngộ độc rượu ethylic.
+ Nhiễm toan acid lactic: do chuyển hóa yếm khí tạo ra nhiều acid lactic. Gặp trong biến chứng
đái tháo đường, shock, động kinh,
luyện tập cơ bắp quá sức.
+ Nhiễm toan chuyển hóa trong suy thận: do cầu thận giảm lọc các anion đặc biệt là sulfat,
phosphat ứ lại hình thành các acid
mạnh
+ Ít gặp: toan acid formic, acid oxalic, acid acetic, acid salicylic,…
+ Mất base: ỉa lỏng cấp nặng, lạm dụng thuốc nhuận tràng
2.5.2. nhiễm acid hô hấp
1. Là hậu quả của sự tăng nồng độ CO2 trong máu, nguyên nhân là do giảm thông khí phế nang.
2. Các biểu hiện đặc trưng:
+ pCO2 tăng
+ Hoạt động bù làm tăng HCO3-
+ pH giảm: còn bù (pH=7,35-7,4), mất bù (pH<7,35)
3. Gặp trong: suy hô hấp cấp (bệnh phổi tắc nghẽn mạn tính, hen phế quản,…), ức chế hô hấp do thuốc,
bệnh thần kinh…
2.5.3. nhiễm kiềm chuyển hóa
* Là hậu quả của sự mất các acid cố định hoặc sự dư thừa chất base trong máu.
* Các biểu hiện đặc trưng:
+ pCO2 bình thường hoặc tăng nhẹ khi có bù của phổi
+ AB tăng, EB tăng
+ pH tăng: còn bù (pH=7,4-7,45), mất bù (pH>7,45)
* Các bệnh lý có nhiễm base (kiềm) chuyển hóa:
+ Do mất acid: nôn nhiều, kéo dài hoặc hút dịch dạ dày
+ Tăng giữ HCO3- ở ống thận:
• Dùng lợi tiểu Furosemide, Thiazide kéo dài
• Dùng một số thuốc như: Penicilline, Carbenicilline
• Hạ kali máu
+ Sử dụng quá nhiều bicacbonat hoặc chất kháng acid
+ Hiếm gặp
2.5.4. nhiễm kiềm hô hấp
1. Là hậu quả của sự giảm nồng độ CO2 trong máu, nguyên nhân là do tăng thông khí phế
nang quá mức.
2. Các biểu hiện đặc trưng:
+ pCO2 giảm
+ AB giảm (bù bởi thận), EB tăng
+ pH tăng: còn bù (pH=7,4-7,45), mất bù (pH>7,45)
3. Gặp trong:
+ Tăng thông khí do lo lắng quá mức, bệnh nhân được hô hấp hỗ trợ, Hysteria.
+ Tăng thân nhiệt
2.5.5. những rối loạn acid – base hỗn hợp
1. Nhiễm acid hô hấp +nhiễm kiềm chuyển hóa: Bệnh nhân nhiễm acid hô hấp kéo dài + điều trị lợi tiểu
quá nhiều
2. Nhiễm kiềm hô hấp + nhiễm acid chuyển hóa: Bệnh nhân ngộ
độc salicylat do uống aspirin quá
liều
3. Nhiễm acid hô hấp + nhiễm acid chuyển hóa: do ngừng hoạt động tim phổi và nhiễm acid chuyển
hóa do tăng acid lactic máu gây
nên do thiếu oxy mô.
4. Nhiễm kiềm hô hấp + nhiễm kiềm chuyển hóa: Bệnh nhân được
hô hấp nhân tạo bằng máy và dùng lợi
tiểu quá mức.
2.5.6. cơ chế bù trong rối loạn thăng bằng acid
- base
* Phổi điều chỉnh thông khí (nhanh, khả năng bù hạn chế)
+ tăng CO2 kích thích tăng thông khí phổi
+ giảm
CO2 kích thích giảm thông khí phổi
* Thận điều chỉnh sự bài tiết H+ và tái hấp thu bicarbonat (chậm, khả năng bù mạnh hơn)
+ Hiệu quả cho những rối loạn xảy ra trong vài ngày
+ Nhiễm acid làm tăng bài tiết H+ và pH nước tiểu giảm
+ Nhiễm kiềm làm tăng bài tiết bicarbonat và pH nước tiểu tăng