ThS. Lan
Mục tiêu
1. cách gọi tên, phân loại quốc tế của enzym (ví dụ mỗi loại)
2. thành phần cấu tạo, trung tâm hoạt động và các dạng cấu trúc của phân tử enzym
3. cấu tạo phân tử và cơ chế hoạt động của coenzym NAD+ và FAD
4. cơ chế hoạt động của enzym
5. phương trình và đồ thị Mechealis-Menten, lineweaver – Burk
6. các yếu tố ảnh hưởng đến hoạt động enzym
I. Đại cương
*Phản ứng hóa sinh:
+ Phản ứng hóa học xảy ra trong
cơ thể sống (bào quan, bào tương,
dịch ngoài tế bào)
+ Phần lớn: phản ứng thuận nghịch do enzym xúc tác
Phản ứng hóa
sinh => quá trình chuyển hóa chất => tổng
hợp/ thoái hóa
*Khái niệm về động
hóa học:
+ Phản ứng không
thuận nghịch: A => B
+ Phản ứng thuận nghịch:
*Khái niệm về năng lượng
tự do:
Năng lượng
sử dụng dưới dạng công (G)
Phản ứng: A
=> B
∆G = GB – GA
GB < GA: tỏa nhiệt (phản ứng thoái hóa), tự xảy ra. Ví dụ, phản ứng oxy hóa.
GB > GA: thu nhiệt (phản ứng tổng hợp), không tự xảy ra, cung cấp năng lượng. Ví dụ, phản ứng
tổng hợp chất, co cơ, dẫn truyền thần kinh, vận chuyển chất qua màng.
*Khái niệm về xúc tác
sinh học:
+ Là xúc tác trong cơ thể sống
+ Chất
xúc tác sinh học: do tế bào sản
xuất, lượng nhỏ, giúp tăng
nhanh phản ứng hóa sinh.
Bao gồm: Enzym, vitamin và hormon
* Enzym: chất xúc tác sinh học đặc
biệt của cơ thể sống, bản chất Protein, xúc tác cho hầu hết phản
ứng hóa sinh xảy ra trong cơ thể sống
+ Phản ứng enzym xúc tác: phản ứng enzym
+ Chất tham gia phản ứng: cơ chất của enzym
+ Đặc điểm của enzym:
- Không bị tiêu hao trong quá trình phản ứng
- Chỉ làm tăng tốc độ phản ứng
- Có bản chất protein
- Có tính đặc hiệu cao: tuyệt đối, tương đối
- Chỉ hoạt động ở vùng nhiệt độ và pH nhất định
+ So
sánh chất xúc tác vô cơ và hữu cơ
|
Đặc điểm
|
Chất xúc tác vô cơ
|
Chất xúc tác hữu
cơ
|
|
Bản
chất hóa học
|
Phân
tử nhỏ: 1 vài nguyên tố
|
Protein
|
|
Tăng
tốc độ pư
|
10^2-10^6 lần
|
10^6 – 10^11 lần
|
|
Các
điều kiên:
•Nhiệt độ •pH •Áp suất |
100
0C
Acid/kiềm mạnh Cao (vài at) |
Thấp
(35-45 oC)
pH sinh lý (7,4) Áp suất khí quyển (1 at) |
|
Thay
đổi cấu trúc
|
Không
|
Có
thay đổi, trở lại cấu trúc
ban đầu khi kết thúc |
|
Tính
đặc hiệu
|
Thấp
|
Cao
|
II. Cách gọi tên và
phân loại
1. Cách gọi tên
Có 4 cách gọi tên:
- Tên cơ chất và thêm tiếp vĩ ngữ ase:
VD:
cơ chất ure + ase = urease
cơ chất protein + ase = protease
- Tên tác dụng + tiếp vĩ ngữ ase:
VD:
Tác dụng oxy hóa + ase = oxidase
- Tên cơ chất, tác dụng và thêm tiếp vĩ ngữ ase:
VD:
cơ chất là lactat, tác dụng khử hydro = lactatdehydrogenase
- Tên thường gọi: không có tiếp vĩ ngữ ase
VD: trypsin, chymotrypsin
2. Phân loại enzym
• Theo EC phân loại theo phản ứng mà nó xúc tác
=> 6 loại (class) => dưới lớp (subclass) => nhóm
(sub-subclass) => một số
enzym
• Mỗi enzym được ký hiệu = mã số EC 4 chữ số, cách nhau bởi dấu chấm
VD: hexokinase EC 2.7.1.1 => Loại enzym 2, Dưới lớp 7, Nhóm
1, Số thứ tự trong nhóm
là 1
2.1. Enzym oxy hóa khử
(oxidoreductase): xúc tác cho phản ứng oxy hóa - khử
AH2 + B => A + BH2
Các dưới lớp:
- Các dehydrogenase: pt không phải oxy (NAD+) nhận e. VD: malatdehydrogenase
- Các oxidase: oxy nhận e. VD: cytochrom oxidase, xanthin
oxidase…
- Các reductase: đưa hydro và điện tử vào cơ chất. VD:
methemoglobin reductase
- Catalase: xúc tác phản ứng phân hủy H2O2 thành O2 và H2O
- Các peroxidase: xúc tác phản ứng: H2O2 + AH2 => A +
2H2O
- Các oxygenase (hydroxylase): gắn 1 nguyên tử oxy vào cơ chất.
VD: cytochrom P-4502. Phân loại
enzym
2.2. Enzym vận chuyển
nhóm (transferase): xúc tác phản ứng vận chuyển 1 nhóm hóa học (không phải hydro) giữa 2 cơ chất:
AX + B => A + BX
- Các aminotransferase: chuyển nhóm –NH2 từ acid amin vào
acid α-cetonic. VD: aspartat
transaminase (AST), alanin transaminase (ALT)
- Transcetolase và transaldolase: chuyển đơn vị 2C và 3C vào
cơ chất. VD: transaldolase,
transcetolase
- Các acyl-, methyl-, glucosyl-transferase, phosphorylase:
VD: acyl transferase…
- Các kinase: chuyển gốc P từ ATP vào cơ chất. VD:
hexokinase
- Các thiolase: chuyển nhóm CoA-SH vào cơ chất. VD: acyl CoA acyltransferase (thiolase)
- Các polymerase: chuyển các Nu từ các NTP vào DNA hoặc RNA.
2.3. Enzym thủy phân
(hydrolase): xúc tác phản ứng cắt đứt liên kết hóa học bằng thủy phân
AB + H2O => AH+ BOH
- Các esterase: thủy phân liên kết ester. VD: triacyglycerol
lipase
- Các glucosidase: thủy phân liên kết glucosid
- Các protease: thủy phân liên kết peptid
- Các phosphatase: thủy phân liên kết este phosphat, tách gốc
P
- Các phospholipase: thủy phân liên kết este phosphat trong phospholipid
- Các amidase: thủy phân liên kết N-osid. VD: nucleosidase
- Các desaminase: thủy phân liên kết C-N, tách nhóm amin
- Các nuclease: thủy phân liên kết este phosphat trong RNA, DNA
2.4. Enzym phân cắt
(lyase): xúc tác phản ứng chuyển đi 1 nhóm hóa học khỏi cơ chất
AB => A + B
- Các decarboxylase: tách nhóm CO2 khỏi cơ chất
- Các aldolase: tách 1 phân tử aldehyd từ cơ chất
- Các lyase: tách đôi 1 phân tử mà không có sự tham gia của H2O
- Các hydratase: gắn 1 phân tử H2O vào 1 phân tử cơ chất
- Các dehydratase: tách 1 phân tử H2O khỏi cơ chất
- Các synthase: gắn 2 phân tử mà không cần ATP
2.5. Enzym đồng phân
(isomerase): xúc tác cho phản ứng biến
đổi giữa các dạng đồng phân của chất hóa học
ABC => ACB
Gồm các dưới lớp:
- Các racemase: chuyển dạng đồng phân dãy D, L
- Các epimerase: chuyển dạng đồng phân epi (2 chất chỉ khác nhau ở 1 C)
- Các isomerase: chuyển dạng giữa nhóm ceton và nhóm aldehyd
- Các mutase: chuyển nhóm hóa học giữa các nguyên tử trong 1 phân tử
2.6. Enzym tổng hợp
(ligase hoặc synthetase): xúc tác phản
ứng gắn 2 phân tử thành 1 phân tử lớn hơn, sử dụng
ATP /các dạng năng lượng khác.
Gồm các dưới lớp:
- Các synthetase: gắn hai phân tử với sự tham gia của ATP.
- Các carboxylase: gắn CO2 vào cơ chất
- Ligase: sử dụng cho việc gắn 2 đoạn nucleotid với nhau. VD: DNA ligase
III. Cấu trúc phân tử
enzym
1. Thành phần cấu tạo
của enzym
- Protein, trọng
lượng phân tử >12.000 Da.
+ Enzym thuần: cấu tạo bởi các acid amin
+ Enzym tạp (holoenzym): Protein + chất cộng tác (cofactor)
-
Cofactor là chất hữu cơ (thường là vitamin và các dẫn xuất) => coenzym (Enzym oxy hóa - khử)
- Cofactor
là kim loại =>
metalloenzym, vai trò:
o Tham gia vào phản ứng xúc tác của enzym
o Hoạt động như một chất oxy hóa khử
o Tạo thành phức hợp với cơ chất
2. Trung tâm hoạt động
của enzym
• Là vùng
gắn cơ chất để xúc tác phản ứng với
cơ chất
• Số lượng: một
hoặc vài trung tâm hoạt
động
• Gồm: những nhóm hóa học và những liên kết tiếp xúc trực tiếp với cơ chất hoặc không trực tiếp
• thành phần
cấu tạo: gồm các acid amin có hoạt tính cao: serin (-OH), cystein (-SH), glutamic (γ-COO-)… là những nhóm phân cực
hoặc ion hóa, có khả năng tạo liên
kết hydro hoặc ion với cơ chất
• Quan hệ giữa trung tâm hoạt động và cơ chất:
Có 2
thuyết:
+Thuyết ổ khóa và chìa khóa: enzym nào xúc tác cho đúng cơ
chất đó (giải thích tính đặc hiệu
tuyệt đối của enzym)
+Thuyết mô hình cảm ứng không gian: enzym có tính linh hoạt, thay đổi cấu hình không gian trong quá
trình xúc tác
3. Các dạng cấu trúc của phân tử enzym
3.1. Enzym đơn chuỗi và đa chuỗi
- Enzym đơn chuỗi (monomer) là enzym chỉ do 1 chuỗi polypeptid cấu tạo nên. VD: lipase, pepsin…
- Enzym đa chuỗi (oligomer hoặc polymer): do hai hoặc nhiều chuỗi polypetid cấu tạo nên. VD: AST: 2 chuỗi, CK: 2 chuỗi,
LDH: 4 chuỗi, GLDH: 40 chuỗi…
3.2. Enzym dị lập thể
(allosteric enzyme)
• Ngoài trung tâm hoạt động còn 1 hoặc vài vị trí dị lập thể
• Chức năng: điều chỉnh hoạt động xúc tác của enzym
• Phân tử enzym dị lập thể có vị trí dị lập thể dương và âm
+ Vị
trí dị lập thể dương A làm cấu hình enzym thay đổi theo vị trí có lợi hơn, enzym đươc hoạt hóa, ái lực với cơ chất S tăng, dễ hình thành ES, tốc độ phản ứng tăng
+ Vị
trí dị lập thể âm có tác dụng ngược lại
• Những chất dị lập thể dương đứng trước cơ chất trong chuỗi phản ứng
• Những chất dị lập thể âm: đứng sau chuỗi phản ứng hoặc là sản phẩm cuối
3.3. Các dạng phân tử của enzym (isozym
hay isoenzym)
• Các dạng tồn tại khác nhau của một enzym, xúc tác 1 loại phản ứng, tính chất hóa học khác nhau
Ví dụ:
_ LDH
là enzym tetramer, do 2 loại chuỗi polypeptid, tổ hợp thành 5 dạng phân tử (isozym) khác nhau
+ LDH1: HHHH (tim)
+ LDH2: HHHM
+ LDH3: HHMM
+ LDH4: HMMM
+ LDH5: MMMM (gan)
_ CK
là dimer, do 2 loại chuỗi
+ CK-BB (não)
+ CK-MB (tim)
+ CK-MM (cơ)
3.4. Các tiền chất của enzym
• Enzym sau khi tổng hợp ở dạng không hoạt động (tiền enzym)
• Sau đó được bài tiết vào môi trường khắc nghiệt, bị thủy phân 1 đoạn polypeptid che lấp
trung tâm hoạt động, chuyển thành
dạng hoạt động
• Tiền enzym có tiếp vĩ ngữ ogen. Ví dụ: pepsinogen, trypsinogen… thủy phân thành pepsin,
trypsin có hoạt tính tiêu hóa protein
• Vai trò quan trọng: bảo vệ cơ thể
3.5. Phức hợp đa enzym
• Phức hợp gồm nhiều enzym khác nhau, liên quan đến nhau
trong 1 quá trình chuyển hóa, kết
tụ thành 1 khối
• Nếu bị tách riêng, các enzym riêng biệt bị biến tính
• Tác dụng: tăng cường hợp tác của các enzym khác nhau, tăng hiệu lực và hiệu quả xúc tác
Ví dụ:
phức hợp đa enzym pyruvat
dehydrogenase xúc tác chuỗi phản ứng
biến đổi pyruvat thành acetyl CoA
IV. Coenzym
• Tham gia cùng enzym trong quá trình xúc tác
• Có ái lực với enzym như ái lực của enzym với cơ chất, gọi
là cơ chất 2
• Coenzym có thể gắn với enzym, có chức năng như 1 vị trí hoạt
động
• Có coenzym vận chuyển nhóm (ATP, CoA), có coenzym OXH khử (NAD+ và CoQ10)
• Phần lớn coenzym là vitamin hoặc dẫn xuất của vitamin
|
Cofactor
|
Vitamin
|
Thành phần phụ
|
Nhóm hóa học được vận chuyển
|
|
Thiamine pyrophosphate
|
Thiamine
(B1)
|
Không
|
Mẩu
2-carbon từ Cα
|
|
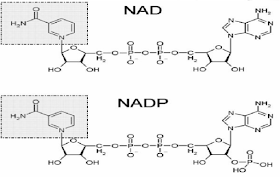
NAD+
and NADP+
|
Niacin
(B3)
|
ADP
|
Electrons
|
|
Pyridoxal
phosphate
|
Pyridoxine
(B6)
|
Không
|
-NH2
và -COOH
|
|
Coenzyme
A
|
Pantothenic acid (B5)
|
ADP
|
Acetyl
group and other acyl groups
|
|
Flavin mononucleotide
|
Riboflavin
(B2)
|
Không
|
Electrons
|
1. Các coenzym oxy
hóa khử
1.1. Các coenzym
Niacin:
• Niacin = Nicotinic Acid + in, là vitamin B3 tan trong nước
• Niacin có thể biến đổi thành 2 coenzym tham gia vào phản ứng
oxy hóa - khử:
NAD+(nicotinamid
adenin dinucleotid)
NADP+
(nicotinamid adenin dinucleotid)
• Chức năng: vận
chuyển 2 e và 1 H+ giữa chất cho và chất nhận H+ trong phản ứng oxy hóa - khử xúc tác bởi enzym dehydrogenase1.
Các coenzym oxy hóa khử
1.2. Các coenzym
Flavin (vitamin B2)
• Có 2 loại:
flavin mononucleotid (FMN)
flavin adenin dinucleotid (FAD)
• Chức năng: trao đổi 2 e và 2 H+
1.3. Các coenzym oxy hóa khử khác
• Các porphyrin Fe2+ (coenzym hem): vận chuyển e nhờ khả
năng biến đổi thuận nghịch giữa
Fe2+ và Fe3+.
=> Là
coenzym của cytochrom, enzym catalase, peroxidase, monooxygenase, dioxygenase
• Acid lipoic: acid béo, có 2 gốc –SH.
=> Tham
gia vào phức hợp khử carboxyl oxy hóa của acid pyruvic và acid α-ceto glutaric
2. Các coenzym vận
chuyển nhóm
• TPP (thiamin pyrophosphat): dẫn xuất của vitamin B1, vận chuyển nhóm CO2
+ Thiếu hụt
vitamin B1 gây ảnh hưởng hệ thần
kinh ngoại biên (bệnh Beri-Beri)
• CoA: có vai trò trong chuyển hóa acid béo, thể cetonic,
acetat và các acid amin
• Biotin: coenzym carboxylase, xúc tác cho sự gắn nhóm CO22.
• Pyridoxan phosphat: dẫn xuất vitaminB6, coenzym của enzym
trao đổi nhóm amin của acid α-amin cho acid α-cetonic;
ngoài ra là coenzym của enzym khử
carboxyl
V. Cơ chế xúc tác của
enzym
1. Sự biến thiên năng
lượng tự do (ΔG < 0)
- Năng
lượng tự do của 1 hệ thống phản ứng là năng lượng có thể tạo ra công G
- Một
phản ứng hóa học chỉ có
thể xảy ra theo chiều năng lượng tự do giảm, biến chất có năng lượng tự do cao thành thấp
A + B = C+ D
G1 > G2
ΔG < 0
Tuy nhiên nhiều phản ứng ΔG < 0 nhưng phản ứng vẫn chưa xảy
ra vì vật chất có sức ỳ về mặt hóa
học
2. Sức ỳ về mặt hóa học
của vật chất
• Sức ỳ về mặt hóa học của vật chất là do các yếu tố sau:
+ Yếu tố về entropy (sự chuyển động hỗn loạn của các phân tử
vật chất)
+ Lớp áo nước làm mất hoạt tính của cơ chất
+ Hình thể không gian cồng kềnh của cơ chất
+ Sự sắp xếp chưa định hướng của các nhóm chức năng của
enzym
* Để phản ứng hóa học xảy ra:
+ Điều kiện cần: ΔG < 0
+ Điều kiện đủ: cung cấp cho hệ thống phản ứng 1 năng lượng để thắng sức ỳ về hóa học (năng lượng hoạt hóa)
3. Năng lượng hoạt
hóa
• Năng lượng hoạt hóa là năng lượng cần thiết để nâng tất cả
phân tử của 1 mol cơ chất ở 1 nhiệt
độ nhất định lên trạng thái chuyển tiếp, ở
đỉnh của hàng rào năng lượng, để phản ứng enzym có thể xảy ra
• ở trạng thái chuyển tiếp, mỗi phân tử cơ chất có thể sẵn
sàng tham gia vào sự tạo thành sản
phẩm phản ứng
4. Cơ chế tác dụng của
enzym
• Cung cấp năng
lượng: tăng nhiệt độ làm tăng tương tác giữa các ptử
• Hoạt động của enzym: giảm năng lượng hoạt hóa
• Cơ chế: E kết hợp với S tạo thành phức hợp E-S thông qua 2
bước:
Cả 2 phản ứng này đều đòi hỏi năng lượng hoạt hóa thấp
VI. Động học enzym
1. Tốc độ phản ứng
enzym
- Định nghĩa: là lượng cơ chất bị biến đổi dưới tác dụng của enzym ấy ở nhiệt độ 25 oC dưới các điều kiện chuẩn hóa
- Đơn vị tốc độ phản ứng (U hoặc IU): là lượng enzym làm biến đổi 1µmol cơ chất thành sản phẩm trong
1 phút
ở 25 oC dưới các
điều kiện đã chuẩn hóa
- Tốc độ ban đầu (v): tốc độ đầu tiên của phản ứng, chưa bị ảnh
hưởng bởi các yếu tố nhiệt độ, pH… đo hoạt độ enzym chính xác nhất ở tốc độ ban đầu (5 phút đầu của phản ứng)
- Tốc độ cực đại (v max):
khi các phân tử enzym
bão hòa về cơ chất thì phản ứng đạt
tốc độ tối đa
2. Thuyết Michealis –
Menten
- Là giả thuyết về vai trò của nồng độ cơ chất trong việc
hình thành phức hợp ES
• Phương trình đồ thị Michealis menten
_ KM:
tổng hợp các hằng số tốc độ, giá trị bằng nồng độ S cần thiết để tốc độ phản ứng bằng 1/2 Vmax
+ Hằng số đặc
trưng của mỗi E, thể hiện ái lực E-S
+ KM càng nhỏ:
ái lực càng cao và ngược lại
+ Muốn đạt
Vmax, nồng độ S
>> 100 lần
_
Vmax: số vòng quay của E, số phân tử S biến thành sản phầm/ đơn vị thời gian, E bão hòa cơ chất
• PT đồ thị
Lineweaver – Burk:
Vmax khó xác
định, nghịch đảo phương
trình Michealis - menten:
- Xác định
KM và Vmax
- Xác định
pH và nhiệt độ tối ưu
- Xác định
chất ức chế
VII. Các yếu tố ảnh
hưởng đến hoạt động của enzym
1. Nồng độ cơ chất
2. Nồng độ enzym
3. Nhiệt độ
- To tăng ->
v tăng
- To tăng quá cao -> mất hoạt tính E (phụ thuộc: t0, thời
gian tiếp xúc)
- To tối ưu = thân nhiệt của cơ thể
- E chịu nhiệt cao: taq
4. pH môi trường
- E hoạt động ở giới hạn pH nhất định (7-8), pH tối ưu
- phòng thí
nghiệm: kiểm soát pH bằng dung dịch đệm
5. Chất hoạt hóa
- Tăng tốc độ phản ứng, E không hoạt động -> hoạt động
- Thường: phân tử nhỏ, ion
- Cơ chế:
+ Tạo vị trí hoạt động (+), tác động vào S (-)
+ ổn định cấu hình và cấu trúc E, E dễ gắn S
+ Liên kết E-S hoặc coenzym – S
+ Tạo Oxy
hóa hoặc khử
6. Chất ức chế
Chất kết hợp với E -> giảm hoặc mất hoạt tính E
6.1. Ức chế cạnh
tranh:
- Chất ức chế có cấu trúc tương tự S -> cạnh tranh gắn trung tâm hoạt động
- Sự ức chế thuận nghịch
- Thoát ức chế = tăng nồng độ
S
- Vmax không đổi nhưng Km lớn hơn
6.2. Ức chế không cạnh
tranh
- Gắn vào E hoặc phức hợp ES
- Cơ chế:
. thay
đổi cấu hình E => thay đổi trung tâm hoạt động => không gắn S
. Gắn
ES => không biến đổi S thành sản
phẩm
. Tăng
nồng độ S không ảnh hưởng
đến sự gắn của chất ức chế
. Làm
giảm Vmax, Km không đổi
6.3. ức chế phi cạnh
tranh
- Chất ức chế gắn vào ES thành phức hợp E-S-I, không tạo sản phẩm
- Tăng nồng
độ S => tăng sự ức chế vì cung cấp nhiều ES
- Giảm Vmax và giảm Km